Au premier semestre de cette année, la plateforme d'information sur les normes du groupe national a annoncé les « Directives techniques pour la stratégie de contrôle de la contamination ( CCS ) dans la production pharmaceutique stérile » ( T/CPAPE 01-2024 ) organisées par la China Pharmaceutical Equipment Engineering Association . a été publié en septembre 2023. Un projet pour commentaires a été publié le 7 juin et a sollicité l'avis du public. Il a maintenant été officiellement mis en œuvre le 1er juin 2024 . Bien que ces lignes directrices ne soient pas obligatoires, elles fournissent une référence technique aux entreprises de production pharmaceutique et de R&D, aux unités de conception d'usines, aux fabricants d'équipements, etc., et jouent un rôle directeur important dans l'amélioration du contrôle de la pollution dans le processus de production pharmaceutique.
L'essor du concept de stratégie de contrôle de la contamination ( CCS ) n'est pas accidentel. Il s'agit d'un choix inévitable pour des générations de médecins de rechercher la qualité des médicaments ...
D'où vient la Stratégie de contrôle de la contamination ( SCC ) ?
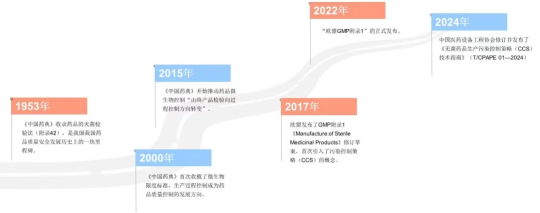
D'où vient la Stratégie de contrôle de la contamination ( SCC ) ?
Garantir la qualité des médicaments est une préoccupation majeure du pays et fondamentale pour la population. En raison de leur particularité, les médicaments stériles sont devenus la cible des autorités réglementaires à tous les niveaux de l’industrie. Dès l'édition de 1953 de la « Pharmacopée de la République populaire de Chine » ( appelée « Pharmacopée chinoise » ) , la méthode de test de stérilisation des médicaments était incluse (Annexe 42 ). fait référence aux tests pour savoir si la stérilisation des médicaments est complète, y compris les méthodes de test de stérilité pour les médicaments liquides et les méthodes de test de stérilisation pour les médicaments solides. La mise en œuvre de cette méthode d'inspection de stérilisation du produit final est une étape importante dans l'histoire du développement de la qualité et de la sécurité des médicaments en Chine.
Cependant, cette méthode d'inspection présente également certaines limites, telles que l'incapacité d'atteindre une inspection à 100 % , des méthodes d'inspection complexes, un taux de rebut élevé, un coût élevé, etc. Par conséquent, après des décennies de précipitation, l'édition 2000 de la « Pharmacopée chinoise » a finalement inclus des normes de limites microbiennes. Les gens ont progressivement compris que le contrôle des micro-organismes contaminants des médicaments est une mesure importante pour garantir la sécurité des médicaments et que le contrôle du processus de production est la mesure la plus importante. direction de développement du contrôle de qualité pharmaceutique. L'édition 2015 de la Pharmacopée chinoise a commencé à promouvoir le « passage de l'inspection du produit final au contrôle du processus » dans le contrôle microbien des médicaments [1] . Ce concept a perduré jusqu'à ce jour, et le contrôle de la qualité des médicaments stériles est progressivement passé du « contrôle post-événement » au « contrôle avant et pendant l'événement » .
La véritable avancée a eu lieu en décembre 2017 , lorsque l'UE a publié un projet révisé de l'Annexe 1 des BPF « Fabrication de produits médicaux stériles » (appelée « Annexe 1 des BPF de l'UE »), le concept de CSCstratégie de contrôle de la contamination ( a été officiellement confirmé avec la publication de « EU GMP Annexe 1 » le 22 août 2022 . Dans le même temps, le concept de libération paramétrique est également apparu aux yeux du public. À mesure que les conditions de mise en œuvre continuent de mûrir, le contrôle du processus de production de médicaments stériles passera de la détection au contrôle du processus et à la libération des paramètres.
Qu'est-ce qu'une stratégie de contrôle de la contamination ( CSC ) exactement ?
« EU GMP Annex 1 » a une définition claire de la stratégie de contrôle de la pollution ( CSC ) [2] :

La portée applicable de la stratégie de contrôle de la pollution ( CSC ) est définie comme suit par les agences compétentes [3][4][5] :

Pourquoi se soucier des stratégies de contrôle de la contamination ( CSC )
L'essence de la stratégie de contrôle de la contamination ( CCS ) est de contrôler les risques possibles de contamination dans tous les aspects du processus de production pharmaceutique, et d'éliminer / réduire / prévenir les risques de contamination au moyen de mesures scientifiques et systématiques autant que possible, afin de garantir que les entreprises peut produire des produits de haute qualité, sûrs et fiables. Une fois que la pollution se produit, elle entraînera non seulement un gaspillage de matériaux, mais nécessitera également une enquête détaillée et une rectification des sources de pollution, ce qui prend du temps et demande beaucoup de main d'œuvre, et entraînera, dans le pire des cas, une perte énorme ; fait l'objet d'enquêtes et de sanctions par les autorités de régulation, voire de rappels du marché, ce qui est très préjudiciable à l'entreprise. C'est encore plus insupportable.
Maintenant que l'environnement global de l'industrie pharmaceutique nationale est en déclin, que les entreprises choisissent de continuer à être compétitives au niveau national ou de rechercher un développement « à l'étranger », elles doivent améliorer la compétitivité et la conformité de leurs produits. La mise en œuvre d'une stratégie de contrôle de la pollution ( CSC ) est un moyen important d'améliorer la compétitivité et la conformité des produits. En particulier pour les entreprises qui cherchent à « aller à l'étranger », il est encore plus nécessaire de comparer strictement les lois et réglementations internationales pertinentes, telles que « EU GMP Annexe 1 ». ", etc. et l'appliquer strictement.
Si une entreprise souhaite mettre en œuvre une stratégie de contrôle de la pollution ( CSC ), elle doit avoir une compréhension détaillée de l'ensemble du processus de production de ses produits, y compris, sans toutefois s'y limiter, les installations de l'usine, l'équipement, le personnel, les systèmes publics, les matériaux, les produits et les processus. , surveillance environnementale, fournisseurs, etc. attendez. Ces facteurs interagissent et sont interdépendants. Lors de l'évaluation et de la formulation d'une stratégie de contrôle de la pollution ( CSC ), l'impact global de tous les facteurs sur les risques de pollution doit être pris en compte de manière globale, ce qui constitue un défi majeur pour les entreprises.
Les étapes typiques pour développer et maintenir une stratégie de contrôle de la pollution sont les suivantes :
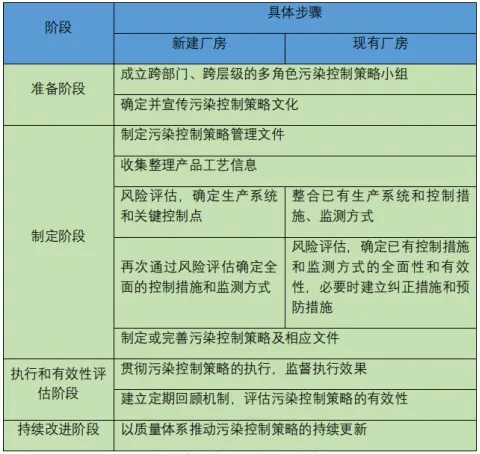
Exemples d'étapes pour élaborer et maintenir une stratégie de contrôle de la pollution
Sur cette base, il n'est pas difficile de voir que la stratégie de contrôle de la contamination ( SCC ) est une exigence inévitable pour se conformer au développement des industries nationales et étrangères. Si les sociétés pharmaceutiques concernées veulent maintenir leur conformité et leur compétitivité, elles doivent en être conscientes. formulation de la stratégie de contrôle de la contamination ( CCS ) Et la maintenance est un processus dynamique et continu Si vous souhaitez toujours être en conformité avec les normes internationales, vous devez intégrer la stratégie de contrôle de la pollution ( CCS ) dans le système qualité de l'entreprise, la rendre correspondante. les dossiers, produire les documents pertinents, résumer et mettre à jour régulièrement.
Éléments de contrôle d' une stratégie de contrôle de la pollution ( CSC )
Installations d'usine
Les installations d'usine sont une garantie nécessaire pour la qualité de la production pharmaceutique. Les fabricants de produits pharmaceutiques doivent organiser un personnel professionnel et technique pour planifier et concevoir les installations d'usine en fonction des exigences des différentes formes posologiques pharmaceutiques, et effectuer les vérifications pertinentes pour confirmer que leurs performances peuvent répondre aux attentes. besoins. Dans le cycle de vie des installations d'usine, une bonne conception ne suffit pas. Leur utilisation, leur entretien, leur réparation et leur surveillance quotidienne sont également des maillons indispensables. Dans le même temps, les installations d'usine doivent également être révisées régulièrement pour garantir qu'elles peuvent continuer à fonctionner. efficacement. Réaliser le contrôle de la pollution. La formulation de stratégies de contrôle de la pollution est indissociable de la prise en compte globale de l’ensemble du cycle de vie des bâtiments et installations des usines.
En prenant l'exemple d'une salle blanche, le choix des matériaux de décoration est directement lié à la propreté, à la sécurité, à la durabilité et aux coûts d'exploitation de la salle blanche. Compte tenu de l'application généralisée de la méthode de désinfection au peroxyde d'hydrogène ( VHP ) dans les salles blanches, des exigences plus élevées ont été imposées à la résistance à la corrosion des cloisons des salles blanches . En tant que fournisseur de solutions d'assemblage de décoration pour salles blanches / laboratoires, United Pharma a lancé la plaque d'acier de couleur anti - VHP United Pharma Zhenkang® en réponse à cette demande. Après des tests internes rigoureux et une vérification sur le terrain par les clients de United Pharma, ce produit a démontré des avantages significatifs :
§L'épaisseur du revêtement de surface de la plaque d'acier de couleur anti - VHP United Pharma Zhenkang® peut atteindre ≥150 μm , dépassant de loin celle de la plaque d'acier de couleur enduite de pré-rouleau ordinaire ( PPGI ), montrant une excellente résistance au peroxyde d'hydrogène. De plus, par rapport au revêtement de fluorocarbone (PVDF) et au revêtement de polyester (PE) pré-enduits au rouleau , la plaque d'acier de couleur anti - VHP United Pharma Zhenkang® offre de meilleures performances.
§Par rapport à l'acier inoxydable SS304 , la plaque d'acier de couleur anti - VHP United Pharma Zhenkang® évite non seulement la fatigue visuelle, mais ses caractéristiques de facilité d'entretien réduisent également considérablement les coûts de maintenance et sont plus abordables en termes de prix, offrant aux utilisateurs un coût- choisir efficace.
§équipement
§La gestion des équipements comprend toutes les activités à chaque étape du cycle de vie complet de l'équipement. Un système de gestion des équipements efficace peut prévenir et contrôler au maximum la contamination potentielle dans le processus de production pharmaceutique. La conception, l'utilisation, l'entretien et la réparation des équipements, ainsi que des examens réguliers sont autant de points clés de la stratégie de contrôle de la pollution. Un contrôle insuffisant de tout facteur ou un manque de lien entre les facteurs peuvent entraîner des défauts dans l'ensemble de la stratégie de contrôle de la pollution.
§
§personnel
§ Concernant le personnel dans la production de médicaments stériles, il peut être considéré sous les aspects de contrôle d'autorité, d'hygiène et de santé du personnel, de vêtements propres et de processus de changement, de formation, de certification de qualification de changement de vêtements, de nombre maximum de personnel, de surveillance des vêtements propres, de vêtements changement de qualification, recertification, qualification du personnel La révocation et les pratiques aseptiques exigent que ces dix aspects prennent des mesures préventives pour minimiser la contamination des installations et des produits par des micro-organismes, des pyrogènes / endotoxines et des particules.
§
§Système public
§Le champ d'application des systèmes publics propres comprend les systèmes d'eau purifiée, d'eau pour injection, de vapeur pure et de gaz propre. Avant de concevoir un système public propre, chaque système a besoin d'une exigence utilisateur pour définir les exigences de l'utilisateur. La conception sera conçue en conséquence en fonction des besoins des utilisateurs afin de garantir que ces besoins sont satisfaits. Une fois la conception terminée, toutes les installations, systèmes et équipements de l'usine doivent être confirmés pour garantir qu'ils sont bien installés, fonctionnent correctement et produisent les résultats attendus.
§
§ Le système public constitue la base de la production de médicaments stériles. Afin d'éviter l'introduction d'une contamination pertinente dans le système public lors de son utilisation, il est nécessaire d'effectuer un contrôle périodique ciblé de la qualité du système, de réaliser des plans de maintenance réguliers et d'établir un mécanisme régulier d'examen de la qualité du système et former une analyse des données et des rapports de tendances correspondants (tels que des rapports mensuels et annuels). En plus de l'utilisation normale quotidienne, pour certains arrêts planifiés, maintenance ou arrêts après avoir rencontré des conditions anormales, les entreprises doivent formuler des procédures d'arrêt et de récupération pertinentes pour éviter au maximum la pollution.
§
§matériaux
§ Tout au long du cycle de vie du produit, les matériaux (y compris les matières premières et les matériaux d'emballage primaire) doivent également être contrôlés efficacement dans chaque processus / étape sur la base d'une évaluation des risques.
produits et processus
Pour différents produits et processus, tels que le processus de production aseptique, le processus de stérilisation terminale, le processus de lyophilisation, le processus BFS , le processus FFS , etc., il est nécessaire de concevoir un ensemble de stratégies de contrôle de la pollution qui répondent aux caractéristiques du produit en fonction de l'objectif. du processus ( CCS ). En résumé, tous les risques et exigences associés au traitement aseptique doivent être identifiés, évalués et contrôlés de manière appropriée.
Prenons l'exemple du processus de remplissage de préparations stériles, qui implique plusieurs étapes telles que le nettoyage de l'équipement, la désinfection, le remplissage et le scellement. Dans ce processus, de petites erreurs dans n'importe quelle étape peuvent entraîner une contamination du médicament. Par exemple, lors du démontage et du montage des canalisations de remplissage et des pompes de remplissage, certaines méthodes de remplissage actuelles sont difficiles à fermer la porte et nécessitent des opérations aseptiques et de nettoyage fastidieuses, ce qui pose des défis pour l'assurance de la stérilité des zones clés. En réponse à cela, Zixian Technology a lancé un système de remplissage sans pompe, qui présente des performances exceptionnelles en simplifiant les opérations aseptiques, en améliorant la précision du remplissage, en contrôlant les gouttes et les éclaboussures et en réduisant les dommages par cisaillement :
§La conception du pipeline de ce système permet une visualisation complète. Le tube de pompe de travail est intelligemment placé entre deux rouleaux mobiles et adopte un positionnement automatique du cône, ce qui simplifie grandement le processus d'installation et de démontage. Le processus de remplacement du pipeline ne nécessite que 8 minutes. Par rapport aux pompes en céramique, la durée de fonctionnement peut être réduite de 73 % , réduisant considérablement le risque de contamination bactérienne lors des opérations manuelles et le temps nécessaire à la maintenance des équipements.
§ Ce système connecte uniquement le distributeur et l'aiguille de remplissage via un tuyau. La conception sans valve au milieu élimine complètement les coins morts sanitaires. Pendant le processus de transfert, le liquide n'entrera pas en contact avec d'autres pièces à l'exception du tuyau et du 316L. Tout contact avec le milieu évite grandement le risque de contamination croisée et de contamination stérile.
§ ......
Il est rapporté que Zhixian Technology a conclu une coopération approfondie avec de nombreuses grandes entreprises telles que le groupe Qilu, Beijing Sinovac, le groupe Lunan, Simcere Pharmaceuticals, le groupe Livzon et le groupe Renfu, et a été hautement reconnue par les clients.
environnement
Le point de départ des exigences en matière de surveillance environnementale repose sur les exigences réglementaires ou pharmacopées. Les caractéristiques du produit et les étapes de son processus déterminent le niveau d'environnement de production requis, mais il ne s'agit pas d'une mesure de contrôle en soi. En confirmant si l'environnement répond aux exigences de la réglementation, en fournissant un retour d'information efficace sur les mesures de contrôle de la pollution et en identifiant les sources potentielles de pollution, l'objectif d'amélioration continue des mesures de contrôle peut être atteint.
Dans le même temps, bien que la surveillance environnementale soit un moyen efficace de refléter le niveau de pollution de l'environnement, la variabilité de la méthode de surveillance elle-même est relativement élevée. Les entreprises doivent comprendre que le niveau d'assurance de la stérilité ne repose pas sur la surveillance environnementale et sur un processus aseptique. détection de simulation. Les données de surveillance environnementale visent davantage à identifier les changements dans les contrôles environnementaux qu’à fournir des informations quantitatives sur les niveaux de microbes et de particules dans l’environnement.
En général, depuis que la National Medical Products Administration ( NMPA ) a progressivement rejoint l' ICH et est devenue un demandeur officiel du PIC/S , les lois et réglementations pharmaceutiques nationales se sont davantage alignées sur les normes internationales et, avec elles, les exigences relatives aux normes d'inspection BPF de la Chine ont augmenté. . , coordination des normes d'inspection et renforcement des forces de régulation. Que les sociétés pharmaceutiques nationales produisent et vendent localement ou exportent à l'étranger, l'établissement d'un système complet de stratégie de contrôle de la pollution ( CSC ) est une mesure nécessaire pour faire face à la supervision nationale et étrangère et améliorer la qualité des produits de l'entreprise.
Références
[1] Hu Changqin . État actuel et perspectives de la construction de systèmes de contrôle microbien pharmaceutique [ J ].
[2] " Fabrication de médicaments stériles , production pharmaceutique stérile"
[3] " Comment développer et documenter une stratégie de contrôle de la contamination"
[4] TR90 " Développement d'une stratégie de contrôle de la contamination dans la fabrication pharmaceutique , Développement d'une stratégie de contrôle de la contamination dans la fabrication pharmaceutique"
[5] « Lignes directrices BPF pour les médicaments » ( édition 2023 )
[6] « Directives techniques pour les stratégies de contrôle de la contamination ( CCS ) pour la production pharmaceutique stérile »